Ontwikkeling van voorspellende dosimetrie voor radioembolisatie
Remco Bastiaannet
UMC Utrecht, Divisie Beeld
Achtergrond
Radioembolisatie is een (FDA goedgekeurde en CE gemarkeerde) behandeling van chemoresistente levertumoren, voor patiënten waarvoor chirurgische resectie niet meer mogelijk is. Radioembolisatie bestaat uit het toedienen van miljoenen kleine radioactieve microsferen (glas- of harsbolletjes van ~0.05 mm) in de tumor voedende levervasculatuur. Toediening gebeurt met een microkatheter die via de lies onder angiografische geleiding gepositioneerd wordt. Doordat het tumor- en gezonde leverweefsel een grotendeels gescheiden bloedtoevoer kennen, is er relatief weinig lek van de microsferen naar het gezonde leverweefsel. In de tumor blijven zij permanent geïmplanteerd en bestralen zo de (vaak diffuse) levertumoren van binnenuit. Hierbij wordt het gezonde leverweefsel zo veel mogelijk gespaard.
Veiligheid en Effectiviteit
Uit retrospectief onderzoek blijkt steeds dat patiënten die een relatief hogere dosis op de tumor ontvangen ook een hogere kans hebben op een verkleining van de tumormassa. Voor de kans op complicaties geld het omgekeerde: hoe lager de dosis op het leverparenchym, hoe lager de kans op leverfalen als gevolg van de behandeling. Het is dus zaak een zo goed mogelijke balans te vinden tussen beiden voor iedere patiënt en bij iedere behandeling.
Maar in tegenstelling tot bijvoorbeeld de nauwkeurige planning bij radiotherapie, wordt er voor radioembolisatie momenteel slechts gebruik gemaakt van methoden die bestaan uit het simpelweg schalen van de voorgeschreven hoeveelheid radioactiviteit aan de hand van een (in)directe schatting van de relevante levermassa. Hierbij wordt géén rekening gehouden met de specifieke anatomie en hoe de microsferen (en dus dosis) zich daadwerkelijk verdelen over de lever.
Deze methoden zijn aantoonbaar onjuist. Daarnaast zal er, omwille van de veiligheid op populatieniveau, altijd een neiging van deze schema’s zijn tot onderdosering, wat leidt tot een slechte response op de therapie.
Omdat de effectiviteit van radioembolisatie in veel patiënten wel duidelijk aangetoond is, klinkt de roep om betere en vooral meer personaliseerde, voorspellende dosimetrie steeds luider.
Hypothese
De distributie van de microsferen in de lever wordt uiteindelijk bepaald door de stromingseigenschappen van het bloed en het vaatbed. Deze stromingseigenschappen zijn direct in kaart te brengen doormiddel van zogenaamde perfusiemetingen. Kort gezegd is dit het karakteriseren van de bloedstroming door weefsel met doorlichting, CT of MRI.
De onderzoeksvraag voor dit project was of we deze stromingseigenschappen van de lever kunnen gebruiken om te voorspellen waar de microsferen (en dus dosis) gedeponeerd worden vóórdat de patiënt behandeld wordt. Deze informatie zou de patiëntselectie en therapieplanning kunnen verbeteren.
Methoden
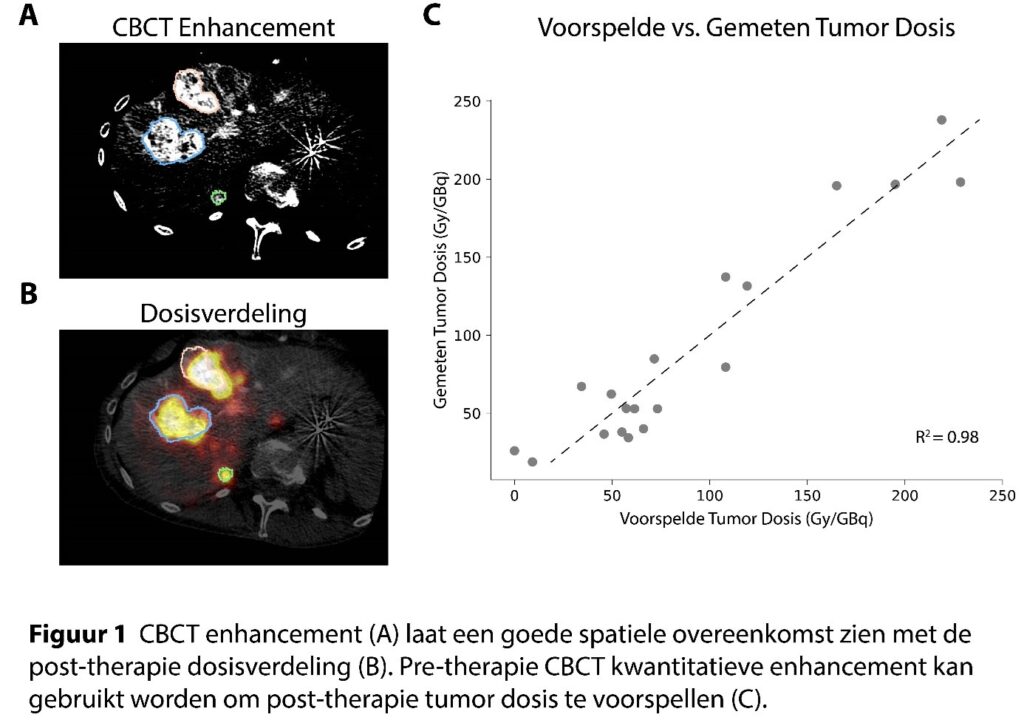
Hiervoor hebben we gebruik gemaakt van zgn. contrast-enhanced cone-beam CT (CBCT) informatie van voor de behandeling. Door de timing van de CBCT opnames strikt te timen ten opzichte van de injectie van het contrastvloeistof, kunnen we relatief eenvoudig kwantitatieve stromingseigenschappen van tumoren in beeld brengen. Bijvoorbeeld tumoren die een goed ontwikkelde bloedtoevoer hebben, en een hoge perfusie kennen, zullen een hogere concentratie contrastvloeistof bevatten op 30 seconden post injectie.
Vervolgens hebben we de geëxtraheerde stromingseigenschappen van tumoren in deze CBCT beelden vergeleken met post-therapie PET/CT beelden. Op deze post-therapie beelden is te zien waar de microsferen zich daadwerkelijk hebben genesteld.
Resultaten
Op het moment van schrijven hebben we 8 patiënten met in totaal 19 tumoren geïncludeerd (allemaal primaire leverkanker). Statistische analyse heeft uitgewezen dat alle berekende stromingseigenschappen significante voorspellers waren voor de uiteindelijke therapeutische tumordosis. Gecombineerd vinden we een uitstekende correlatie (R2 0.98; leave-one-out crossvalidatie). Zie Figuur 1.
Dit betekent dat we met een simpel protocol op de angiokamer nu al erg goed kunnen voorspellen hoe de tumordosis eruit komt te zien, zelfs voordat er radioactieve stofjes zijn toegediend aan de patiënt. Dit stelt ons in staat om patiënten te excluderen voor deze behandeling als blijkt dat geen van de tumoren dosis gaan opnemen. En we kunnen de behandeling beter te sturen door ons te richting op de tumoren waar we wel waarschijnlijk een hoge dosis kunnen verwachten, waarbij andere tumoren eventueel op een andere manier behandeld kunnen worden.
Vervolg
Met deze studie hebben we kunnen aantonen dat het mogelijk is om tumordosis te voorspellen op basis van deze stromingseigenschappen in primaire leverkanker. Openstaande vragen zijn nu nog 1) of we dit ook op basis van normale contrast-enhanced CT of zelfs MRI kunnen doen; 2) of we op basis van betere dynamische (perfusie) scans ook de dosis op het leverparenchym kunnen voorspellen; 3) hoe goed dit werkt voor gemetastaseerde levertumoren.
Met dit project is dus de basis gelegd voor een nieuwe onderzoeksrichting en deze data zullen waarschijnlijk gebruikt gaan worden voor een subsidieaanvraag om dit verder te onderzoeken en valideren voor gebruik in de klinische praktijk.
Verblijf bij Johns Hopkins
Wat het eerste opvalt aan het werken hier, is de enorme schaal van het ziekenhuis en de universiteit. Die massa zorgt ervoor dat, welke richting je ook op gaat met je onderzoek, er altijd wel een (beroemd) expert op dat specifieke gebied rondloopt die je verder kan helpen en met nieuwe ideeën komt. Dr. Frey heeft mij daarin enorm ondersteund en mij telkens voorgesteld aan de relevante mensen. Het is heel bijzonder om deze mensen, bij wijze van spreken, bij de koffieautomaat tegen het lijf te lopen. Dit heeft mijn professionele netwerk enorm uitgebreid.
Daarnaast merk je aan alles hier dat er erg veel nadruk ligt op wetenschappelijk onderzoek. De wetenschappelijke staf is hier altijd bezig met het organiseren van bijeenkomsten en wetenschapsmiddagen om elkaars onderzoeksvoorstellen te bekritiseren, ideeën te generen en te kijken naar mogelijk nieuwe samenwerkingsverbanden. Samen met de schaalgrootte zorgt dit voor een heel dynamische omgeving waar zich veel interessante mogelijkheden voordoen. Dit heeft enorm geholpen met het genereren van nieuwe relevante onderzoekslijnen, waar ik de komende jaren nog mee vooruit zal kunnen.
Dankzij deze beurs van de René Vogels Stichting heb ik zes maanden kunnen verblijven in Baltimore. Tot nu toe heeft dit verblijf een abstract voor een conferentie (met daaropvolgend een paper), een reviewpaper en initiële data voor verder subsidieaanvragen opgeleverd.

