Een prostaatkanker risico-inschattingsmodel voor de huisarts
Jan Verbeek
Erasmus MC
Introductie
De toekenning van de René Vogels reisbeurs maakte het voor mij mogelijk om voor een periode van 4 weken af te reizen naar de Verenigde Staten. In 2016 eindigde de Cleveland Clinic als 2de beste ziekenhuis van de Verenigde Staten. Dat bleek maar eens toen ik aankwam en kennis maakte met de omvang en organisatie van het ziekenhuis. Na de introductiedag heb ik kennis gemaakt met de onderzoeksgroep, waaronder Professor Michael W. Kattan, Professor of Medicine, Epidemiology and Biostatistics. Prof. Kattan is bekend door zijn grote kennis van predictiemodellen en zijn vele publicaties op dit gebied. Tevens heb ik het hoofd van de afdeling Glickman Urological & Kidney Institute, Eric A. Klein, MD, ontmoet. Verder zitten Dr. J. S. Jones en Dr. A. El-Shafei vanuit de Cleveland Clinic in het onderzoeksteam. Het doel van mijn onderzoeksproject is het ontwikkelen van een voor prostaatkanker voorspellend model waarmee de huisarts samen met de patiënt kan nagaan of verdere diagnostiek – waaronder het nemen van prostaatbiopten – zinvol is. Tijdens mijn werkbezoek aan Cleveland heb ik gegevens verzameld van mannen die een prostaatbiopt hebben ondergaan vanwege verdenking op prostaatkanker. Deze gegevens zijn onmisbaar in het ontwikkelen van een internationaal predictiemodel. Met zo’n predictiemodel kunnen onnodige doorverwijzingen naar de tweedelijn, evenals invasieve onderzoeken worden voorkomen.
Achtergrond
Het screenen naar prostaatkanker met alleen PSA resulteert in overdiagnose en overbehandeling van indolente vormen van prostaatkanker. Hierdoor blijft het voordeel van het screenen naar prostaatkanker achterwege (1). Momenteel wordt het niet aangeraden om in Nederland en in het Verenigd Koninkrijk te screenen naar prostaatkanker, echter mannen boven de 50 jaar zijn wel gerechtigd om om een PSA test te vragen. Voor huisartsen blijft het lastig het gebruik van de PSA-test te managen en de uitslag te interpreteren. Hierdoor wordt vaak te snel verwezen naar de uroloog. Het uiteindelijke doel van het gebruik van het predictiemodel door huisartsen is tweeledig: (1) het voorkomen van verwijzingen en daarmee het doen van onnodige biopten; (2) alleen die mannen identificeren met een agressievere vorm van prostaatkanker die gebaat zijn bij een verwijzing naar de uroloog (2).
Op dit moment zijn er al een aantal risico-inschattingsmodellen beschikbaar, zoals de Prostaatwijzer die is gebaseerd op data van de European Randomized study of Screening for Prostate Cancer (http://www.prostaatwijzer.nl/risk-calculators) (3). Huisartsen maken echter nog weinig gebruik van dergelijke modellen, omdat deze alleen de percentuele kans op een kwaadaardige tumor weergeven zonder verder advies. Tevens wordt momenteel geen rekening gehouden met de levensverwachting van een patiënt.
Door het verzamelen van klinische patiëntgegevens in Cleveland en het combineren van deze data met patiëntgegevens uit de andere centra kan uiteindelijk een groot internationaal geaccepteerd model worden ontwikkeld wat gebruiksvriendelijks is voor de huisarts. Tevens zal het model flexibel zijn om nieuwe biomarkers voor prostaatkanker te evalueren.
Uitgevoerde onderzoek
In de periode dat ik in de Verenigde Staten was heb ik gegevens verzameld van meer dan 10.000 patiënten. Dit alles ging in het begin zeker niet zo makkelijk. Bij aankomst moest eerst nog toegang worden geregeld en wilde men eerst zelf nog een keer de data bekijken voordat ze mij deze toegang gaven. Daar moest ik even op wachten. In de tussentijd heb ik met hulp vanuit de Cleveland Clinic afspraken kunnen maken met het Sunnybrook Hospital in Toronto, Canada (één van de andere onderzoekscentra betrokken bij dit project). Dit was mogelijk omdat er een goede samenwerking is tussen de Cleveland Clinic en het Sunnybrook Hospital. Zodoende heb ik data over nog eens 5.000 patiënten voor dit project kunnen meenemen.
Waar ik veel van heb geleerd, en eerder niet mee in aanraking ben gekomen, waren de legal issues rondom het delen van patiëntdata (data sharing agreement). Gelukkig ging dit voorspoedig en hielp de afdelingsbeheerder mij hiermee. Toen ik eenmaal toegang had tot de gegevens van de Cleveland Clinic moest ik de data opschonen. Dit heb ik gedaan door de data op een aantal gebieden te dubbelchecken; een arbeidsintensieve opdracht.
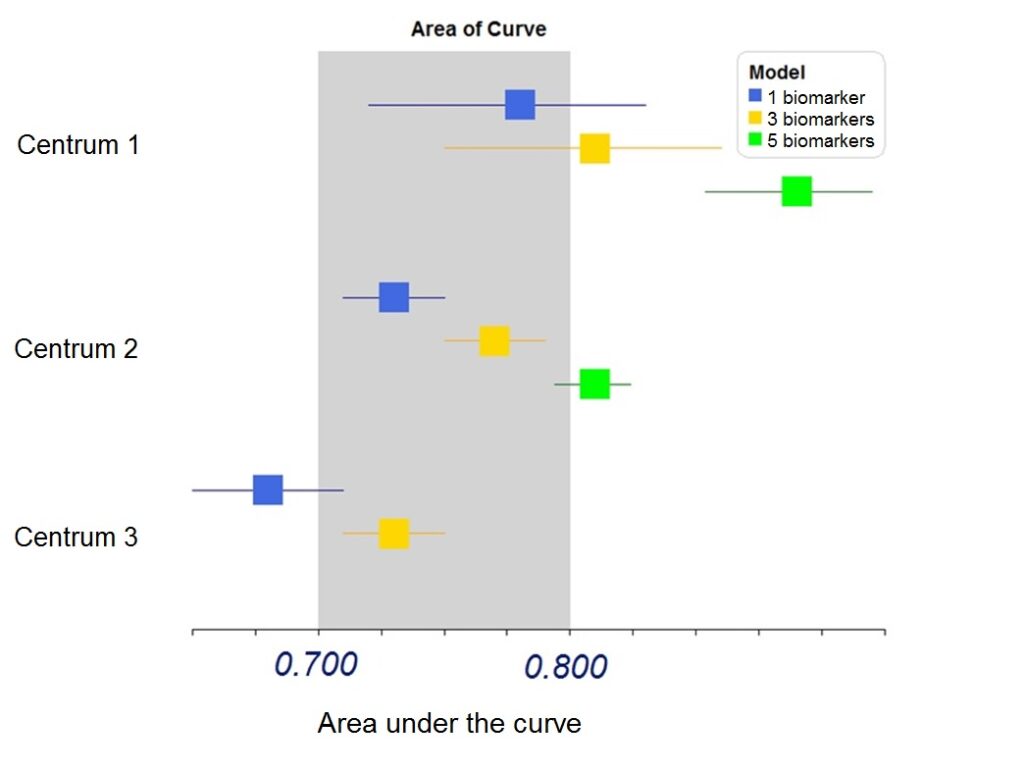
Hierna heb ik de voorspellende waarde van 3-tal modellen onderzocht (figuur 1). De voorspellende waarde kan onder andere worden uitgedrukt met de Area Under the Curve (AUC). Waarbij een AUC van 1.0 het perfecte voorspellende model is en een AUC van 0.5 een nietszeggende model is. Op dit moment is het nog te vroeg om één model als volwaardig te publiceren, omdat data vanuit Zweden en Londen nog moeten worden meegenomen. Verdere validatie en beoordeling van additionele biomarkers moeten tevens plaatsvinden. Uiteindelijk wordt de uitkomst van het risico inschattingsmodel gecombineerd met de levensverwachting om zo per patiënt een goed advies te geven. Dit zal komend jaar verder worden ontwikkeld. Als afsluiting heb ik een foto toegevoegd van Professor Kattan en mijzelf.
Referenties
- Schröder FH, Hugosson J, Roobol MJ, Tammela TL, Ciatto S, Nelen V, et al. Screening and prostate-cancer mortality in a randomized European study. N Engl J Med. 2009;360(13):1320- 8.
- Sooriakumaran P, Nyberg T, Akre O, Haendler L, Heus I, Olsson M, et al. Comparative effectiveness of radical prostatectomy and radiotherapy in prostate cancer: observational study of mortality outcomes. BMJ. 2014;348:g1502.
- Roobol MJ, Schroder FH, Hugosson J, Jones JS, Kattan MW, Klein EA, et al. Importance of prostate volume in the European Randomised Study of Screening for Prostate Cancer (ERSPC) risk calculators: results from the prostate biopsy collaborative group. World J Urol. 2012;30(2):149-55.
